Czy powietrze, którym oddychamy, może przyczyniać się do globalnego kryzysu antybiotykooporności?
Nowe badania opublikowane w The Lancet Planetary Health (2023) wskazują na alarmujący związek między zanieczyszczeniem powietrza a rozprzestrzenianiem się genów oporności na antybiotyki. Odkrycie to otwiera nową perspektywę na walkę z jednym z najpoważniejszych zagrożeń zdrowotnych XXI wieku.
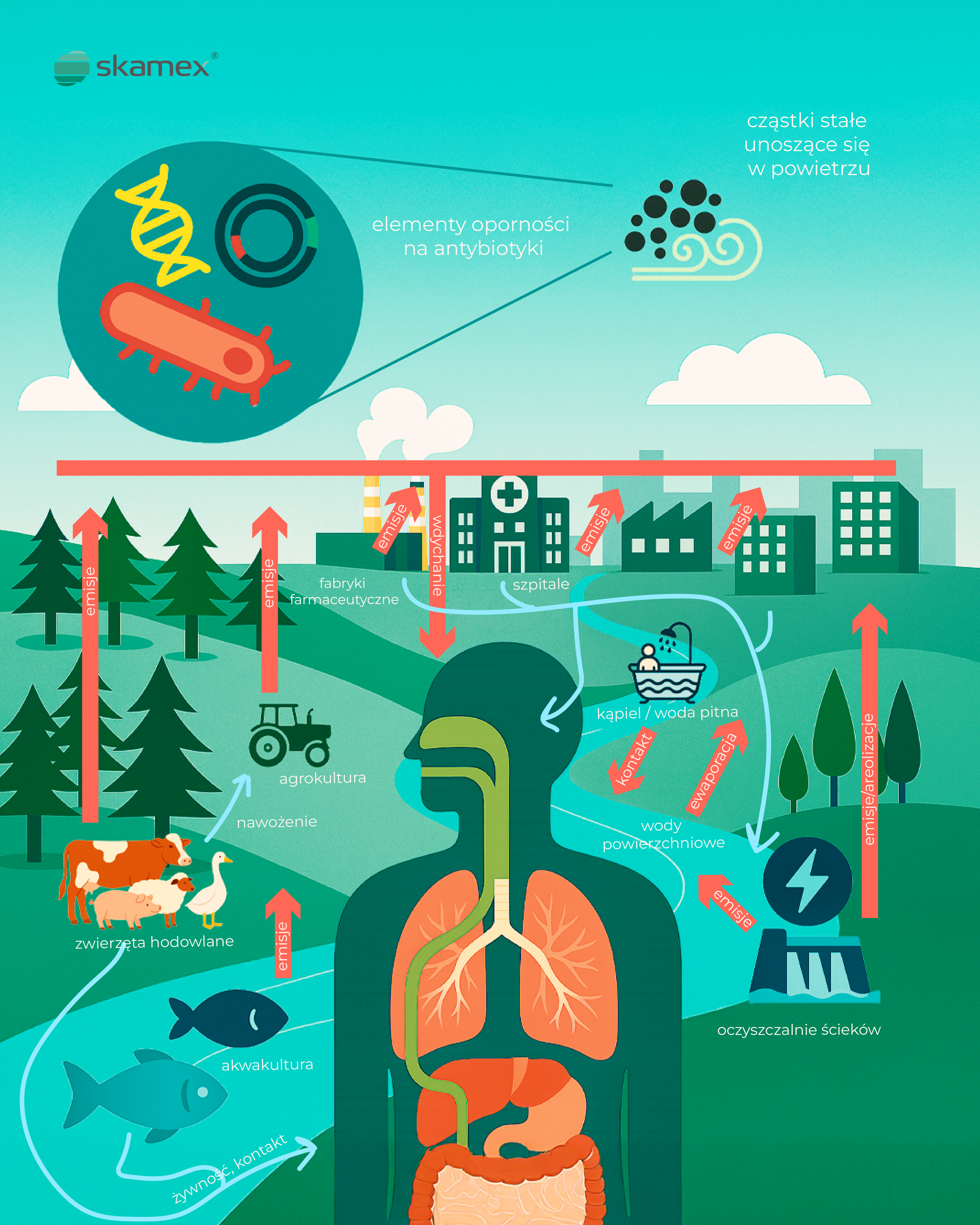
PM2,5 i elementy oporności antybiotykowej – niewidzialne zagrożenie
Zanieczyszczenie powietrza pyłem zawieszonym PM2,5 (cząstki o średnicy mniejszej niż 2,5 mikrometra) od lat łączy się z chorobami układu oddechowego, sercowo-naczyniowego czy nowotworami. Jednak według najnowszych analiz, PM2,5 może również przenosić elementy genetyczne odpowiedzialne za antybiotykooporność – tzw. antibiotic resistance elements (AREs).
Te mikroskopijne cząstki mogą działać jak nośniki bakterii opornych na leki oraz genów, które po przedostaniu się do organizmu – przez wdychanie, spożycie lub kontakt ze skażoną wodą czy żywnością – mogą zwiększać ryzyko trudnych do leczenia infekcji.
Źródła skażenia – od szpitali po przemysł medyczny
Schemat opublikowany w The Lancet Planetary Health przedstawia złożony system emisji i cyrkulacji AREs:
- Szpitale i fabryki farmaceutyczne emitują do atmosfery odpady zawierające leki i bakterie oporne.
- Społeczności miejskie i oczyszczalnie ścieków przyczyniają się do emisji, zarówno do powietrza, jak i do wód powierzchniowych.
- Rolnictwo i hodowla zwierząt – stosowanie antybiotyków prowadzi do przedostawania się ich pozostałości do gleby, wody, a przez pylenie – także do atmosfery.
- Akwakultura wprowadza antybiotyki do środowiska wodnego, które może trafiać do łańcucha pokarmowego.
- Producenci wyrobów medycznych, takich jak rękawice jednorazowe, którzy nie posiadają wdrożonych i certyfikowanych systemów zarządzania jakością, bezpieczeństwem i ochroną środowiska, mogą istotnie przyczyniać się do emisji PM2,5 – szczególnie jeśli korzystają z nieodnawialnych źródeł energii, np. z opalania węglem.
Ludzie mają kontakt z tymi zanieczyszczeniami na wiele sposobów – przez oddychanie, kontakt przez skórę, spożycie skażonej wody lub żywności, a nawet kąpiel w zanieczyszczonych zbiornikach.
Ukryte koszty ochrony zdrowia – nie każdy produkt chroni w pełni
Warto również podkreślić, że nawet działania podejmowane w celu ochrony zdrowia – jak stosowanie środków ochrony indywidualnej – mogą mieć negatywne konsekwencje, jeśli ich produkcja nie uwzględnia aspektów środowiskowych. Produkcja wyrobów medycznych bez niskoemisyjnych technologii, bez stosowania energii odnawialnej i bez nadzoru jakościowego może zwiększać zanieczyszczenie powietrza i pośrednio wspierać rozwój oporności bakterii.
Dlatego odpowiedzialne zakupy, oparte na certyfikacji i ekologicznych standardach produkcji, powinny być elementem polityki zrównoważonego rozwoju w ochronie zdrowia.
Innowacyjne rozwiązania w placówkach medycznych
W ramach ograniczania ryzyka transmisji bakterii opornych w środowisku medycznym, szczególnie w szpitalach i gabinetach, ważne jest stosowanie i wdrażanie odpowiednich środków ochrony indywidualnej. Najnowocześniejsze technologie produkcyjne pozwalają na wprowadzanie innowacyjnych rozwiązań, które gwarantują jego najwyższą jakość, bezpieczeństwo, jak również chronią środowisko.
Rozwiązaniem są rękawice, które łączą ochronę skóry z troską o środowisko.
Jednym z takich rozwiązań są rękawice posiadające warstwę ochronno-nawilżającą, która jest bezpieczna dla osób z atopowym zapaleniem skóry (AZS) oraz wymienione na liście produktów farmaceutycznych do ochrony skóry USP. Produkcja danych rękawic jest przy wdrożonych i certyfikowanych najwyższych standardach zarządzania jakości i bezpieczeństwa w myśli polityki zrównoważonego rozwoju w ochronie zdrowia, jak również przyczynia się do zmniejszenia ryzyka podrażnień i reakcji alergicznych u personelu medycznego.
Kolejnym rozwiązaniem są rękawice produkowane są z materiału nie zawierającego akceleratorów chemicznych ani siarki, co minimalizuje ryzyko wystąpienia alergii typu I i IV. Rękawice posiadają powłokę polimerową bez silikonu wykonaną z innowacyjnego materiału „SyNovus Plus”, który charakteryzują się wysoką odpornością zapewniającą doskonałą równowagę między wytrzymałością a miękkością, oferując użytkownikowi wysoki komfort noszenia. Cały proces produkcji odbywa się przy obniżonej emisji CO₂ w zakładach zasilanych energią odnawialną oraz opatrzone międzynarodowymi certyfikatami środowiskowymi, a sam materiał z którego wykonane są rękawice może być poddawany recyklingowi.
Zastosowanie obu rozwiązań w placówkach medycznych nie tylko chroni personel przed potencjalnymi alergenami i podrażnieniami, ale także zwiększa komfort pracy oraz ochrony przed potencjalnymi zagrożeniami związanymi z długotrwałym narażeniem na czynniki zewnętrzne.. W obliczu globalnych wyzwań związanych z antybiotykoopornością i zanieczyszczeniem powietrza, takie innowacyjne podejście do środków ochrony osobistej jest krokiem w kierunku zdrowszej przyszłości. Takie podejście pokazuje, że ochrona zdrowia może iść w parze z odpowiedzialnością za środowisko.
Wnioski i zalecenia
Badacze podkreślają, że wzrost stężenia PM2,5 może być odpowiedzialny za nawet 11% wzrost oporności bakterii w niektórych regionach świata. Co więcej, prognozy na kolejne dekady są alarmujące – do 2050 roku zanieczyszczenie powietrza może odpowiadać za setki tysięcy zgonów rocznie związanych z infekcjami odpornymi na leczenie.
Dlatego autorzy apelują o integrację polityki zdrowia publicznego z działaniami na rzecz ochrony środowiska. Kluczowe działania to:
- redukcja emisji pyłów zawieszonych PM2,5,
- poprawa zarządzania odpadami farmaceutycznymi,
- ograniczenie nadużywania antybiotyków w medycynie i rolnictwie,
- oraz promowanie niskoemisyjnej, certyfikowanej produkcji sprzętu medycznego, w tym środków ochrony indywidualnej.
Summary
Zanieczyszczenie powietrza to nie tylko problem klimatyczny czy pulmonologiczny – to także ukryty czynnik napędzający globalną antybiotykooporność. Nowe badania pokazują, jak złożone i wieloźródłowe są mechanizmy rozprzestrzeniania się genów oporności, i jak ważne jest systemowe podejście – obejmujące zdrowie ludzi, zwierząt i środowiska.
Czyste powietrze i czysta produkcja to nie tylko cele ekologiczne, ale i warunek skutecznej walki z globalnym kryzysem zdrowotnym.
Sources:
- Zhu, Y.-G., Zhao, Y., Li, B., Huang, C.-L., Zhang, S.-Y., Yu, S., et al. (2023).
Air pollution and antibiotic resistance: A global relationship revealed by a multi-country study.
The Lancet Planetary Health, 7(9), e649–e659.
https://doi.org/10.1016/S2542-5196(23)00152–4
- World Health Organization (WHO). (2020).
Antimicrobial resistance and the environment: An emerging area of concern.
https://www.who.int/publications/i/item/9789240014472
- Chatterjee, A., Modarai, M., Naylor, N. R., Boyd, S. E., Atun, R., Barlow, J., & Holmes, A. H. (2018).
Quantifying drivers of antibiotic resistance in humans: a systematic review.
The Lancet Infectious Diseases, 18(12), e368–e378.
https://doi.org/10.1016/S1473-3099(18)30296–2
- Li, B., Yang, Y., Ma, L., Ju, F., Guo, F., Tiedje, J. M., & Zhang, T. (2015).
Metagenomic and network analysis reveal wide distribution and co-occurrence of environmental antibiotic resistance genes.
The ISME Journal, 9, 2490–2502.
https://doi.org/10.1038/ismej.2015.59
- Chen, Q.-L., An, X.-L., Li, H., Su, J.-Q., Ma, Y., & Zhu, Y.-G. (2016).
Long-term field application of sewage sludge increases the abundance of antibiotic resistance genes in soil.
Environment International, 92–93, 1–10.
https://doi.org/10.1016/j.envint.2016.03.026
- Ashbolt, N. J., Amezquita, A., Backhaus, T., Borriello, P., Brandt, K. K., Collignon, P., et al. (2013).
Human Health Risk Assessment (HHRA) for environmental development and transfer of antibiotic resistance.
Environmental Health Perspectives, 121(9), 993‑1001.
https://doi.org/10.1289/ehp.1206316
- van Bruggen, A. H. C., Finckh, M. R., & He, M. (2023).
Airborne routes of antibiotic resistance gene transmission in the environment.
Frontiers in Microbiology, 14, 1163212.
https://doi.org/10.3389/fmicb.2023.1163212
- European Centre for Disease Prevention and Control (ECDC). (2023).
Antimicrobial resistance surveillance in Europe 2023 – Annual report.
https://www.ecdc.europa.eu/en/antimicrobial-resistance/surveillance-and-disease-data/report
- OECD. (2022).
Tackling antimicrobial resistance: Ensuring sustainable investment in AMR.
Organisation for Economic Co-operation and Development.
https://www.oecd.org/health/tackling-antimicrobial-resistance.htm
- Kümmerer, K. (2009).
Antibiotics in the aquatic environment–a review–part I.
Chemosphere, 75(4), 417–434.
https://doi.org/10.1016/j.chemosphere.2008.11.086
 Polski
Polski
