Andrzej Jerzy Wrona, Dominik Chodor, lek Jarosław Zgajewski, lek Michał Piotrowski
Żródło: “Przegląd Urologiczny”, 2019, nr 118.
Obecnie złotym standardem leczenia chorych z naciekającym mięśniówkę rakiem pęcherza moczowego jest zabieg radykalnej cystektomii. Pacjenci poddawani cystektomii radykalnej wymagają równocześnie rekonstrukcji drogi odpływu moczu. Wśród sposobów odprowadzenia moczu możemy wymienić przetoki moczowodowo-skórne, pęcherz ortotopowy, wewnętrzne kontynentne zbiorniki jelitowe oraz niekontynentne, wśród których dominuje wstawka jelitowa [1].
Jednym z najczęściej wykonywanych sposobów odprowadzenia moczu jest wstawka jelitowa. Istnieją dwa główne typy zespolenia moczowodów ze wstawka jelitową: zespolenie sposobem Brickera oraz zespolenie sposobem Wallace. Technika Brickera polega na spatulacji moczowodów i wszycie każdego moczowodu oddzielnie do boku wstawki jelitowej. W technice Wallace możemy wyróżnić 2 typy. W typie I moczowody rozcina się, ustawia równolegle obok siebie i zszywa wewnętrznymi brzegami. Tak zespolone moczowody wszywa się do bliższego końca wstawki jelitowej. W typie II rozcięte moczowody zszywa się w ten sposób że koniec dalszy jednego moczowodu przyszywa się do szczytu nacięcia drugiego moczowodu, a następnie tak jak w typie I zespala się z końcem bliższym wstawki jelitowej [1, 3].
Jednym z powikłań odprowadzenia moczu poprzez wstawkę jelitowa jest zwężenie zespolenia moczowodowo-jelitowego [2]. Zwężenie jest zwykle bezobjawowe i może prowadzić do wodonercza, pogorszenia funkcji nerek, zakażenia układu moczowego a w ostateczności do utraty nerki [10, 6]. Opisywane są różne metody leczenia zwężenia moczowodowo-jelitowego. Najczęściej wykonywana procedurą jest zabieg otwarty wycięcia zwężenia i ponownego zespolenia moczowodów ze wstawka jelitową [2].
Zabieg jest możliwy również do wykonania techniką laparoskopową lub z asystą robota [7, 9, 8]. Alternatywne leczenie obejmuje techniki endoskopowe jak poszerzenie zwężenia balonem, endoskopowe nacięcie zwężenia, lub założenie cewnika DJ [2, 4, 8]. W przypadku braku możliwości zastosowania jakiegokolwiek leczenia chorzy wymagają założenia permanentnej przeskórnej nefrostomii w celu zachowania funkcji nerki. Celem artykułu jest przedstawienie nowej metody leczenia zwężenia moczowodowo-jelitowego z zastosowaniem protezy Detour (pomost miedniczkowo-jelitowy).
Budowa protezy Detour i opis zabiegu
Proteza Detour składa się z zewnętrznej tuby wykonanej z politetrafluoroetylenu (PTFE) wielkości 27F oraz wewnętrznej silikonowej tuby wielkości 17F. Wewnętrzna tuba na każdym końcu wystaje poza zewnętrzną część. Na granicy części wewnętrznej i zewnętrznej końca nerkowego protezy znajduje się radioczuły pierścień, który markuje nam prawidłowe położenie protezy w nerce (ryc.1).
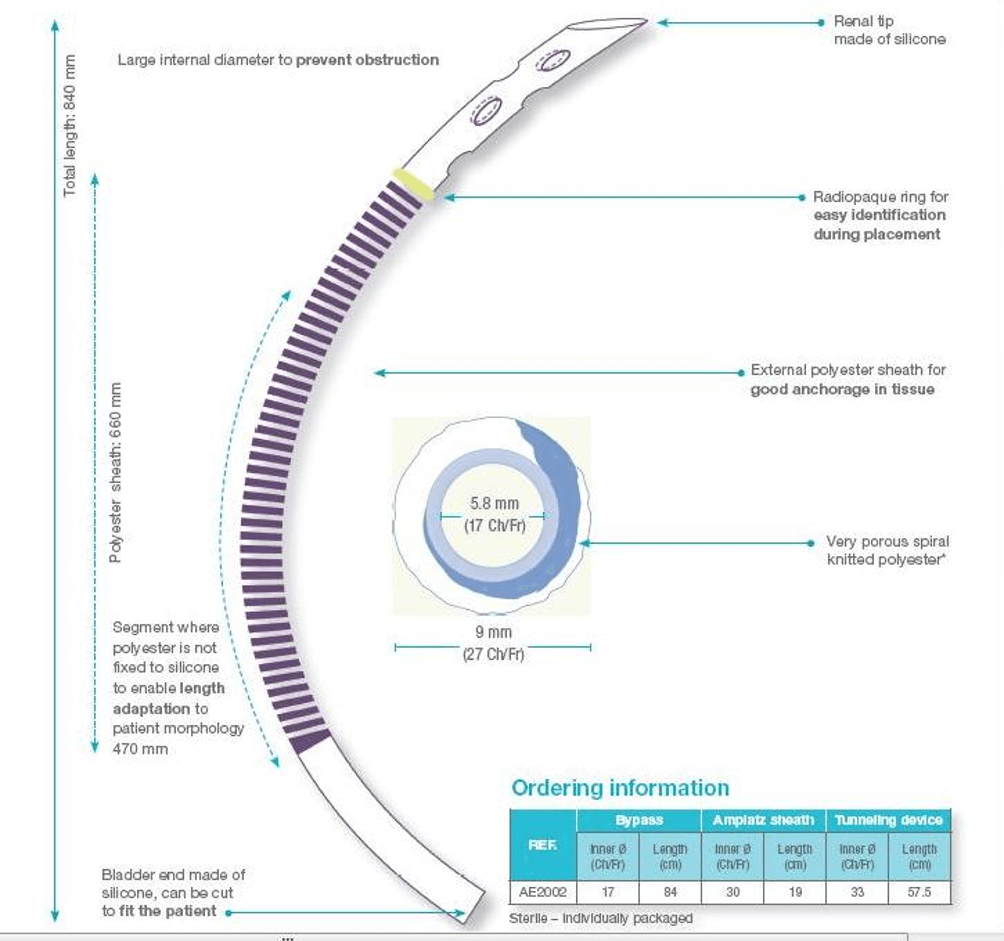
Rycina 1: Budowa protezy Detour (Użyte za zgodą Colplast, Inc)
Zabieg wykonywany jest w znieczuleniu ogólnym. Pacjent jest układany w pozycji na boku z lekko skręconą miednicą, aby mieć łatwy dostęp zarówno do okolicy lędźwiowej jak urostomii. Następnie stół jest składany w pół, aby uwypuklić bok pacjenta. Wkłucie do nerki wykonujemy pod kontrolą USG oraz RTG nieco do boku, aby uniknąć zaginania się protezy Detour w miejscu w którym opuszcza nerkę i kieruje się w kierunku urostomii (ryc.2).
 Rycina 2: Wprowadzona igła do UKM nerki lewej. Zdjęcie od przodu pacjenta. Pacjent leży na prawym boku, głowa pacjenta po stronie lewej, pępek widoczny u dołu zdjęcia (urostomia niewidoczna).
Rycina 2: Wprowadzona igła do UKM nerki lewej. Zdjęcie od przodu pacjenta. Pacjent leży na prawym boku, głowa pacjenta po stronie lewej, pępek widoczny u dołu zdjęcia (urostomia niewidoczna).
Przez koszulkę Amplatz’a pod kontrolą RTG wprowadzamy protezę Detour do nerki (ryc.3).
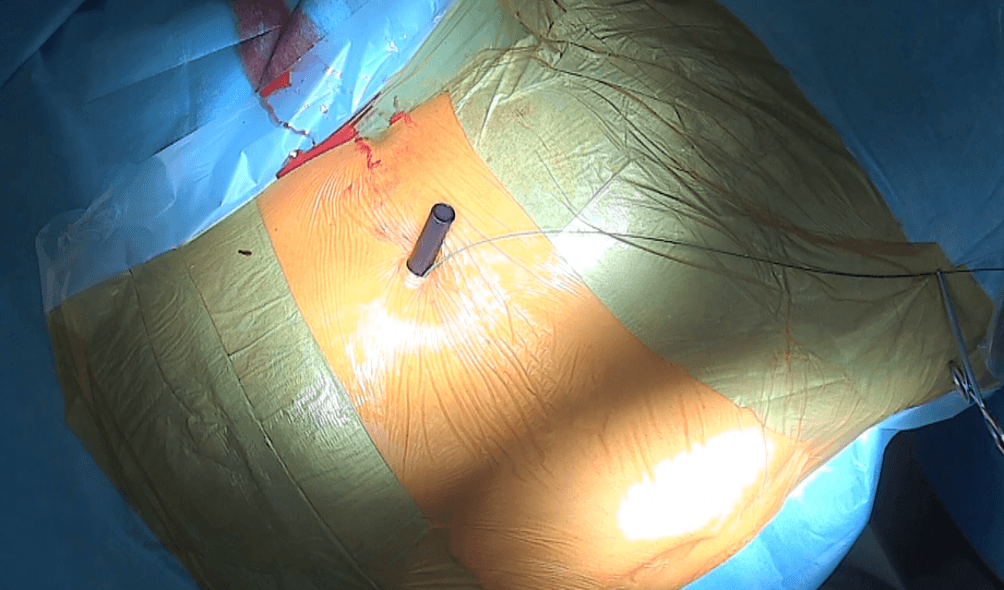 Rycina 3: Wytworzony dostęp do UKM nerki lewej ‑widoczna koszulka Amplatz’a 30F i na prawo od niej drut bezpieczeństwa.
Rycina 3: Wytworzony dostęp do UKM nerki lewej ‑widoczna koszulka Amplatz’a 30F i na prawo od niej drut bezpieczeństwa.
Radioczuły znacznik w proksymalnej części protezy pomaga ustabilizować jej pozycję tak, aby osłona PTFE była objęta miąższem nerki i nie wnikała do UKM co zapobiega inkrustacjom a jednocześnie miąższ nerki stabilizuje protezę (ryc.4)
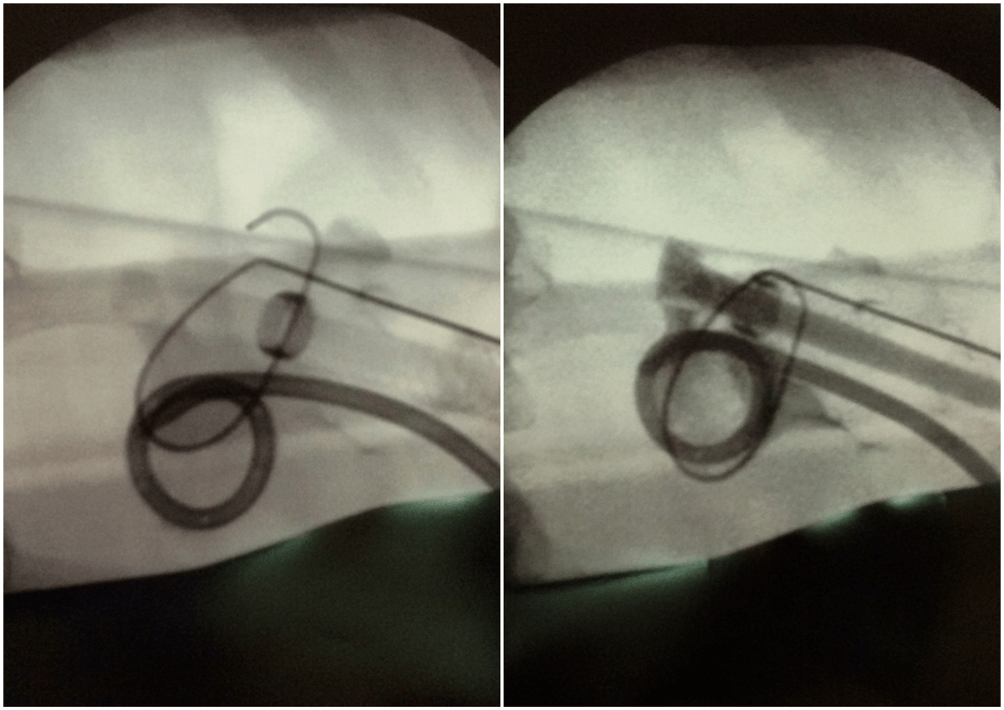 Rycina 4: Śródoperacyjne zdjęcia RTG w trakcie implantacji protezy — po lewej widoczna proteza Detour powyżej drenu nefrostomijnego. Widoczny jest radioczuły pierścień (strzałka) markujący położenie punktu granicznego między częścią wewnętrzną i zewnętrzną końca nerkowego protezy. Po prawej moment podawania kontrastu przez protezę — widoczna oznaczone strzałką zakontrastowane światło protezy (17F).
Rycina 4: Śródoperacyjne zdjęcia RTG w trakcie implantacji protezy — po lewej widoczna proteza Detour powyżej drenu nefrostomijnego. Widoczny jest radioczuły pierścień (strzałka) markujący położenie punktu granicznego między częścią wewnętrzną i zewnętrzną końca nerkowego protezy. Po prawej moment podawania kontrastu przez protezę — widoczna oznaczone strzałką zakontrastowane światło protezy (17F).
Gdy proteza jest prawidłowo położona usuwamy koszulkę Amplatz’a. Proteza Detour jest przeprowadzana podskórnie. Tunel do przeprowadzenia protezy z okolicy lędźwiowej do okołostomijnej wykonujemy za pomocą plastikowej odpowiednio szerokiej tuby (ryc.5).
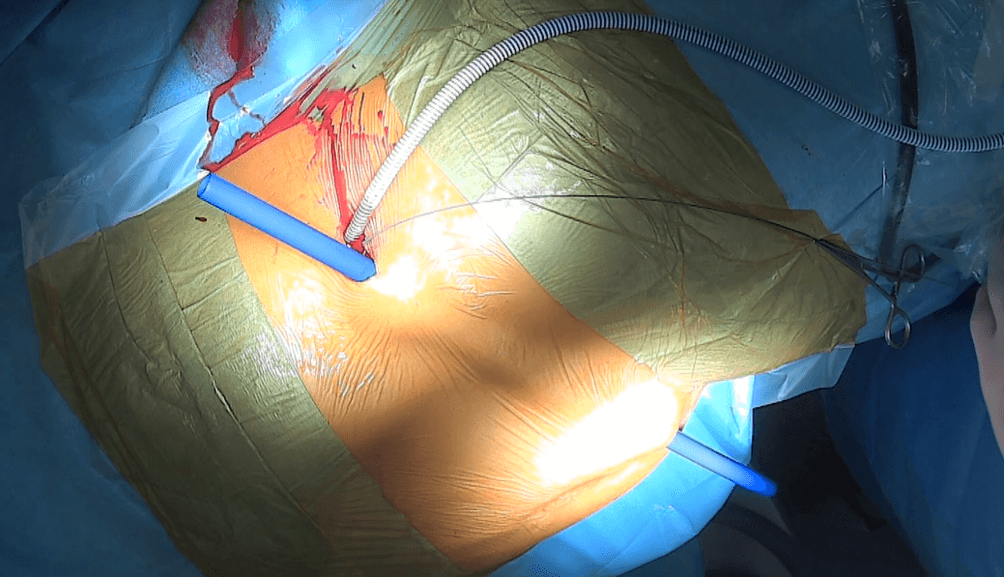 Rycina 5: Proteza Detour (27F) wprowadzona do nerki prawej. Wytworzenie podskórnego kanału dla protezy Detour — widoczna niebieska plastikowa tuba przeprowadzone przez ciecie wytworzone uprzednio w lewej okolicy lędźwiowej, tkankę podskórną, wyprowadzona przez ciecie kilka cm poniżej i na prawo od pępka.
Rycina 5: Proteza Detour (27F) wprowadzona do nerki prawej. Wytworzenie podskórnego kanału dla protezy Detour — widoczna niebieska plastikowa tuba przeprowadzone przez ciecie wytworzone uprzednio w lewej okolicy lędźwiowej, tkankę podskórną, wyprowadzona przez ciecie kilka cm poniżej i na prawo od pępka.
W przypadku zakładania protezy do nerki lewej ze względu na dużą odległość między okolicą lędźwiową lewą a urostomią położoną po prawej stronie oraz dużą krzywiznę podskórnego toru przeprowadzanie protezy pod skórą przeprowadza się dwuetapowo, najpierw przeprowadza się protezę na przednią powierzchnię jamy brzusznej tam wykonujac nacięcie skóry i wyprowadzając protezę przez to nacięcie (ryc.6, ryc.7).
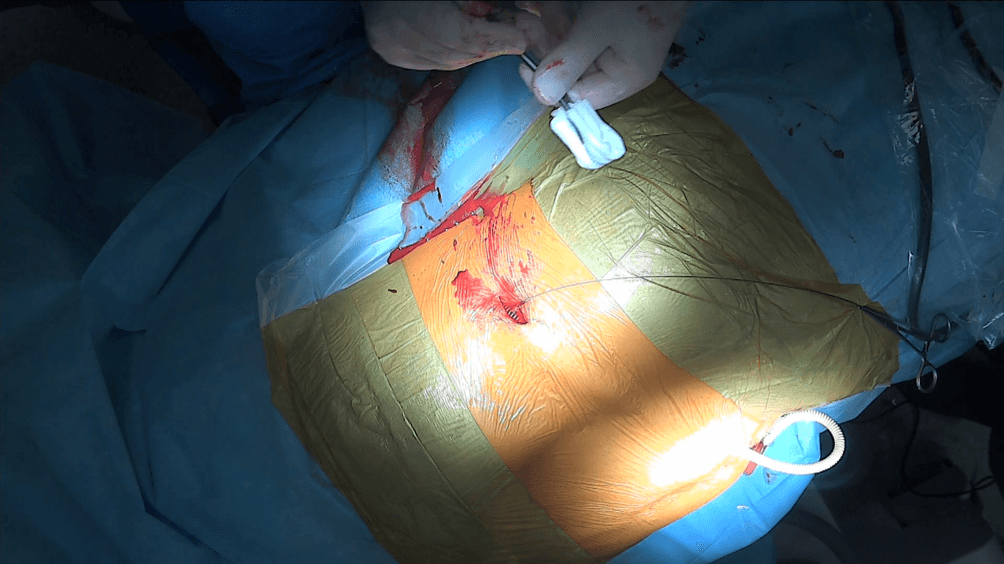 Rycina 6: Proteza Detour (27F) przeprowadzona w tkance podskórnej.
Rycina 6: Proteza Detour (27F) przeprowadzona w tkance podskórnej.
.png)
Rycina 7: Zdjęcie wykonano z innej pozycji od przodu pacjenta. Głowa pacjenta znajduje się po stronie lewej. U góry zdjęcia widoczny opatrunek założony na ranę w okolicy lędźwiowej lewej. Widoczna proteza Detour wychodząca z cięcia umiejscowionego poniżej pępka. Na dole widoczna urostomia.
Z pośredniego nacięcia wytwarza się następnie kanał podskórny dochodzący do bocznej ściany urostomii w jej części nadpowięziowej (Ryc.8).
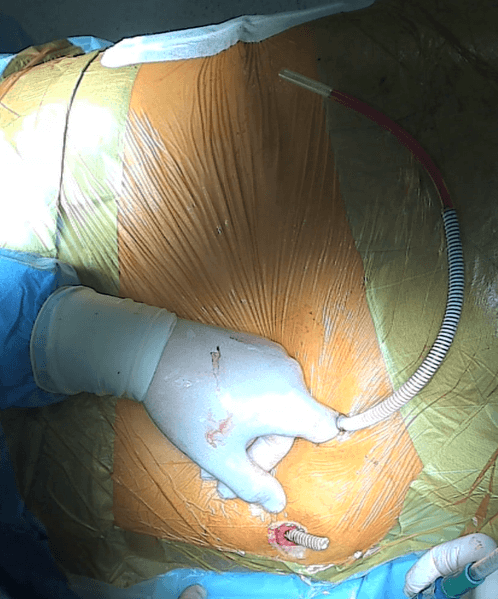
Rycina 8: Wytwarzanie podskórnego kanału dla protezy Detour na tępo za pomocą palca. Obok palca wystaje proteza założona do nerki lewej która ma być dopiero wszczepiona do urostomii. Z urostomii wystaje koniec dystalny protezy Detour założonej wcześniej w czasie innego zabiegu do nerki prawej.
Nastepnie nacina się scianę jelita od wewnątrz i przez nacięcie przeprowadza się platikowa tubę przez którą zostanie przeprowadzona proteza Detour (Ryc.9).
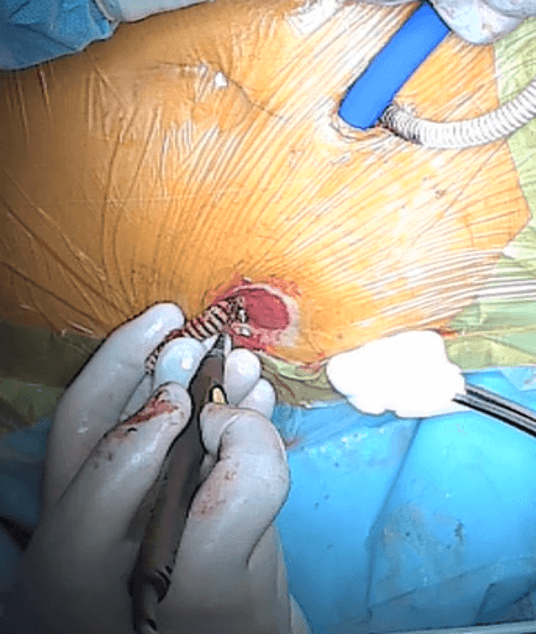
Rycina 9: Moment nacięcia śluzówki wstawki jelitowej.
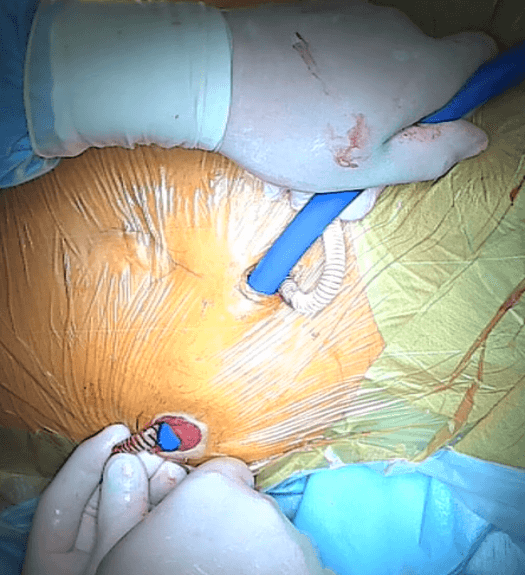
Rycina 10: Moment wprowadzania plastikowej tuby do wstawki jelitowej.
Dystalna część protezy jest skracana do odpowiedniej długości, a zewnętrzna powłoka PTFE jest jest przyszywana do śluzówki jelita (Ryc.11).
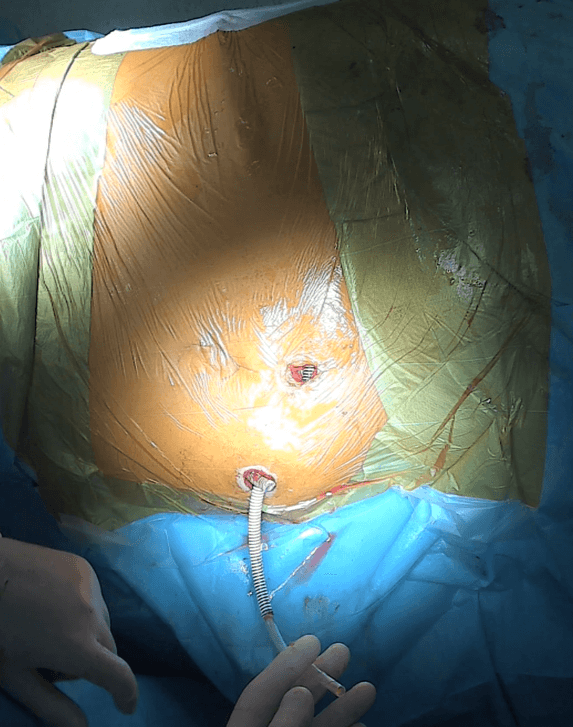
Rycina 11: Lewa proteza Detour (27F) wprowadzona do wstawki jelitowej wymaga jeszcze skrócenia i przyszycia do ściany wstawki. Obok niej widoczny dystalny koniec prawej protezy.
Po zabiegu zakładany jest cewnik Foleya do wstawki jelitowej.
Opis przypadku
Pacjent lat 72 w kwietniu 2016 roku przebył zabieg cystoprostatektomii radykalnej odprowadzeniem moczu przez wstawkę jelitową. Po zabiegu był dwukrotnie hospitalizowany z powodu ciężkiej sepsy, było to odpowiedznio w maju i czerwcu 2016 roku. W lipcu 2016 w USG stwierdzono u chorego poszerzenie układu kielichowo-miedniczkowego III stopnia po stronie prawej. We wrześniu 2016 wykonano u pacjenta zabieg przezskórnej nefrostomii do nerki prawej.
Wykonano pielografię zstępującą stwierdzając brak przedostawania się kontrastu do wstawki jelitowej. W pażdzierniku 2016 wykonano endoskopię wstawki jelitowej z próbą udrożnienia zwężenia zespolenia moczowodowo-jelitowego po stronie prawej. Wobec braku efektu zabiegu chory pozostał z nefrostomia po stronie prawej. W późniejszym okresie obserwowano u chorego anemię, nasilenie zaburzeń gospodarki węglowodanowej oraz cechy biochemiczne niewydolności nerek.
W listopadzie 2017 roku uwidoczniono w USG poszerzenie układu kielichowo-miedniczkowego po stronie lewej. W marcu 2018 roku chory był hospitalizowany z powodu infekcji dróg moczowych przebiegającej z gorączką. Następnie w kwietniu 2018 roku wykonano zabieg przezskórnej nefrostomii po stronie lewej. Do tutejszego oddziału chory został przyjęty w pażdzierniku 2018 roku. Pacjent został zakwalifikowany do zabiegu implantacji protezy Detour do wstawki jelitowej po stronie prawej. Poziom kreatyniny przez zabiegiem wynosił 151umol/L, eGFR 43ml/min/1,73m^2. Dnia 10.10.2018r w znieczuleniu ogólnym wykonano zabieg implantacji protezy Detour do nerki prawej i do wstawki jelitowej. Czas zabiegu wyniósł 60min. Nie wystąpiły żadne powikłania śródoperacyjne ani wczesne pooperacyjne. Parametry funkcji nerek po zabiegu utrzymywały się w podobnych wartościach jak przed zabiegiem. Wykonano pielografię zstępującą uwidaczniając prawidłowy spływ kontrastu przez protezę (Ryc.12).
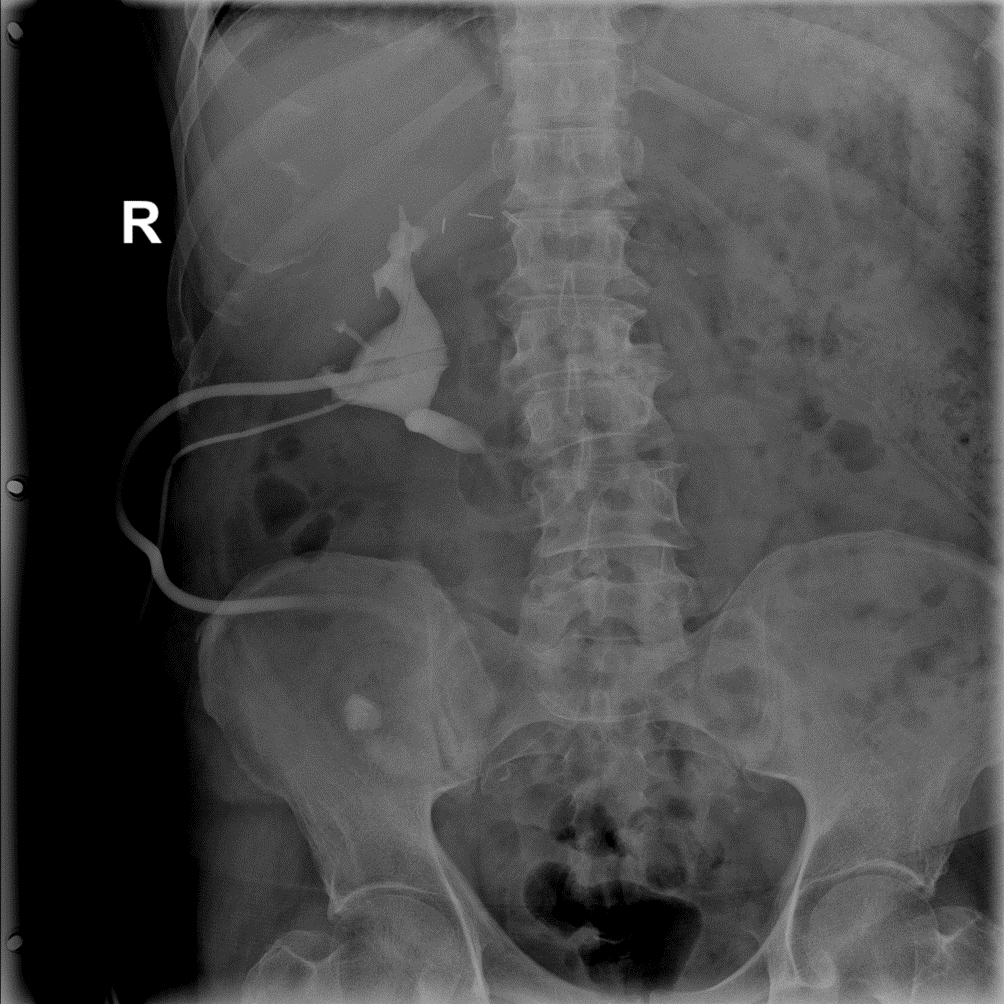 Rycina 12: Pielografia zstępująca prawostronna poprzez założoną nefrostomię- widoczne zakontrastowanie UKM nerki prawej oraz protezy Detour.
Rycina 12: Pielografia zstępująca prawostronna poprzez założoną nefrostomię- widoczne zakontrastowanie UKM nerki prawej oraz protezy Detour.
W 7. dobie od zabiegu operacyjnego usunięto nefrostomię z nerki prawej. W 9. dobie pooperacyjnej chory został wypisany do domu. W styczniu 2019 roku chory był hospitalizowany w innym ośrodku z powodu infekcji układu moczowego z towarzyszącą gorączką spowodowaną zagięciem się końcówki protezy Detour znajdującej się we wstawce jelitowej i jej zatkaniem przez czop śluzowy. Po udrożnieniu protezy uzyskano prawidłowy pasaż moczu z nerki prawej.
W kwietniu 2019 roku chory został ponownie planowo przyjęty do Oddziału Urologii tutejszego szpitala. W okresie przedoperacyjnym chory był leczony antybiotykiem z powodu infekcji w drogach moczowych (Enterococcus faecalis). Dnia 04.2019r w znieczuleniu ogólnym wykonano zabieg implantacji protezy Detour do nerki lewej i do wstawki jelitowej. Czas zabiegu wyniósł 60min. Nie wystąpiły żadne powikłania śródoperacyjne ani wczesne pooperacyjne. Ze względu na niewielką przestrzeń wewnątrz wstawki jelitowej i ryzyko zagięcia protez i ich zatkania przez śluz jelitowy końcówkę obu protez Detour ułożono tak żeby nieznacznie wystawały przez urostomię na zewnątrz (Ryc.13, Ryc.14).
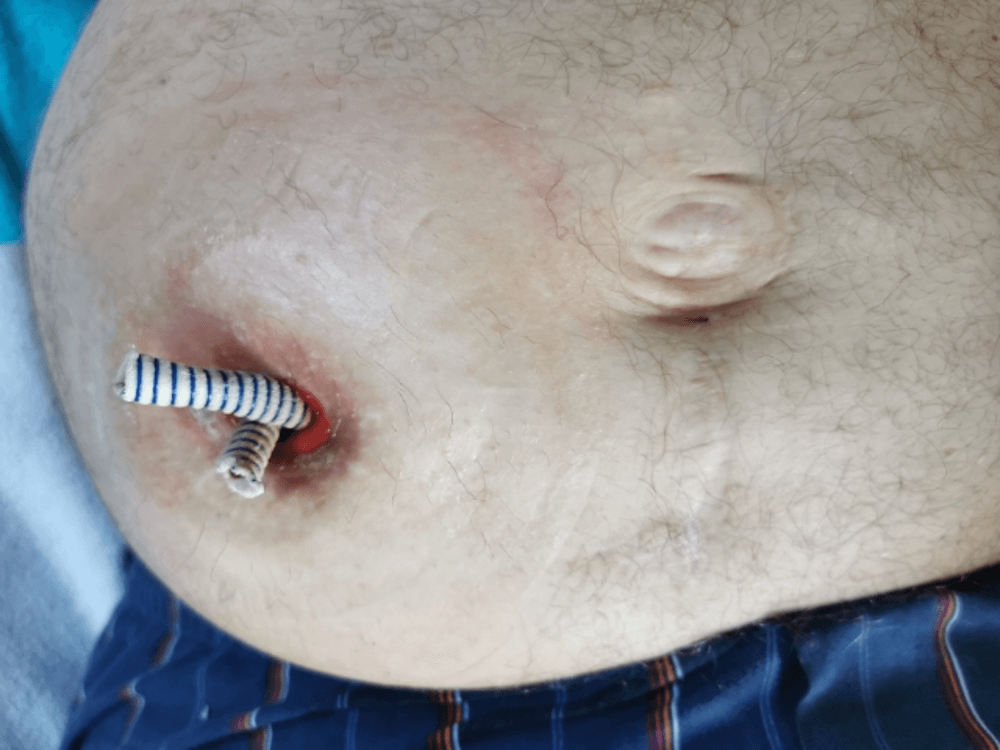 Rycina 13: Protezy Detour wyprowadzone poza wstawkę na zewnątrz celem lepszego pasażu moczu. Zdjęcie przed przyklejeniem płytki worka urostomijnego.
Rycina 13: Protezy Detour wyprowadzone poza wstawkę na zewnątrz celem lepszego pasażu moczu. Zdjęcie przed przyklejeniem płytki worka urostomijnego.
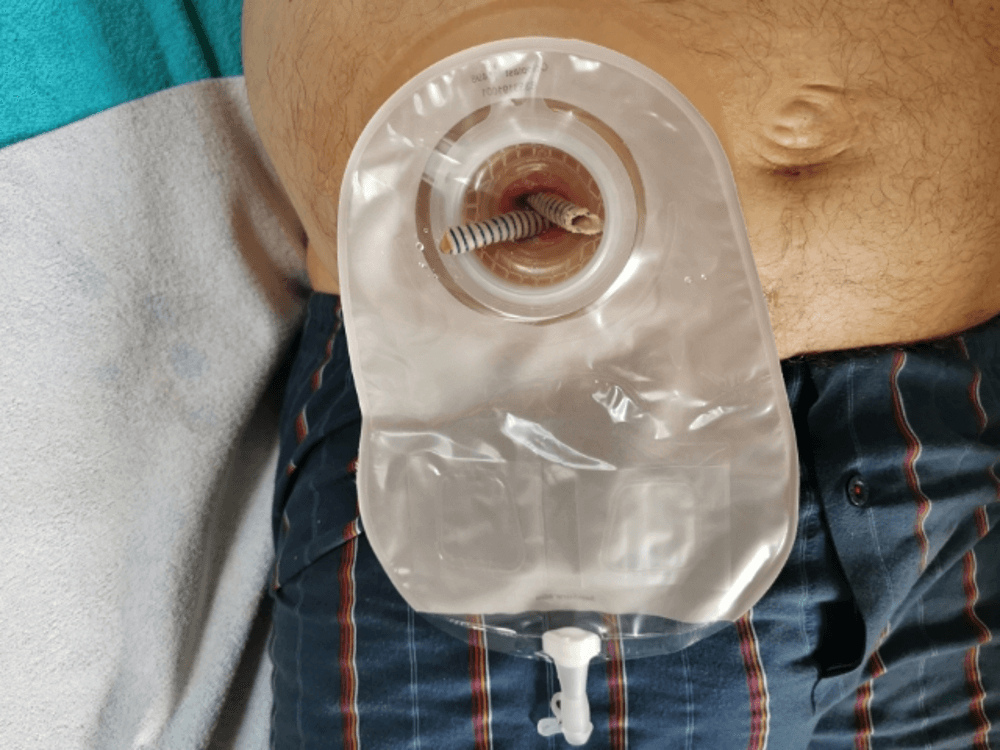 Rycina 14: Protezy Detour wyprowadzone poza wstawkę na zewnątrz celem lepszego pasażu moczu. Widok po przyklejeniu płytki.
Rycina 14: Protezy Detour wyprowadzone poza wstawkę na zewnątrz celem lepszego pasażu moczu. Widok po przyklejeniu płytki.
Po zabiegu wykonano pielografię zstępującą uwidaczniając prawidłowy spływ kontrastu przez protezę (Ryc. 15).
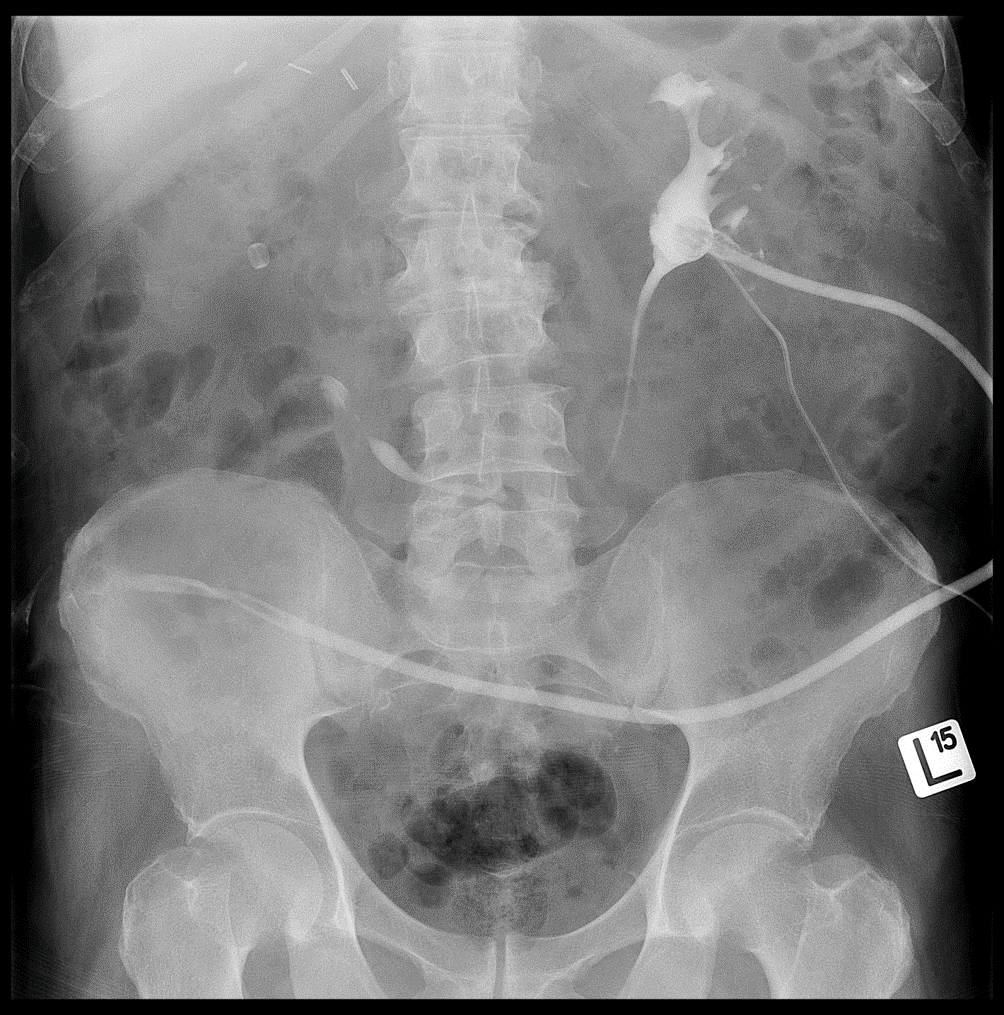 Rycina 15: Pielografia zstępująca lewostronna poprzez założoną nefrostomię- widoczne zakontrastowanie UKM nerki lewej oraz protezy Detour. W rzucie nerki prawej widoczny radioczuły pierścień prawej protezy Detour.
Rycina 15: Pielografia zstępująca lewostronna poprzez założoną nefrostomię- widoczne zakontrastowanie UKM nerki lewej oraz protezy Detour. W rzucie nerki prawej widoczny radioczuły pierścień prawej protezy Detour.
W 5 dniu po operacji usunięto nefrotomie z nerki lewej. W 7 dobie od zabiegu pacjent został wypisany do domu. Po zabiegu nie obserwowano powikłań. Aktualnie pacjent czuje się dobrze, protezy drenują mocz prawidłowo.
Podsumowanie
Do tej pory implantacja sztucznego moczowodu była wykonywana w przypadku uropatii zaporowej z przeszkodą występującą na poziomie moczowodu. Proteza Detour była stosowana u pacjentów zarówno z nowotworową jak i łagodną przyczyną niedrożności moczowodu [12, 13, 14, 15]. W literaturze są również opisywane przypadki wykorzystania tej metody u chorych po transplantacji nerki [11, 16, 17, 18]. Zwężenie zespolenia moczowodowo-jelitowego u chorych poddanych zabiegowi cystektomii radykalnej z odprowadzeniem moczu poprzez wstawke jelitową moży być kolejnym wskazaniem do zastosowania protezy Detour.
U chorych u których inne metody zawiodły lub nie ma możliwości zastosowania innych metod leczenia sposobem odprowadzenia moczu pozostaje przezskórna nefrostomia. Przeskórna nefrostomia wiąże się z obniżeniem jakości życia pacjentów i nie jest też wolna od powikłań. [19, 20]. Implantacja protezy Detour może być z powodzeniem wykorzystana u tych chorych. Sama procedura nie jest skomplikowana, dodatkowym atutem jest mała inwazyjność zabiegu. Implantacja sztucznego moczowodu wiąże się z ryzykiem wystąpienia powikłań zarówno wczesnych jak i późnych, dlatego pacjenci wymagają bacznej obserwacji w okresie pooperacyjnym oraz późniejszych kontroli.
Wcześnie zdiagnozowane powikłania mogą być w odpowiedni sposób zaopatrzone [14, 21, 22]. Z powodu eksperymentalnego charakteru tej procedury potrzeba więcej badań oraz dłuższego okresu obserwacji, aby w pełni móc ocenić jej skuteczność w dłuższym terminie. Niemniej jednak implantacja sztucznego moczowodu u opisanego w tym artykule chorego znacząco podniosła jego komfort życia i pozwoliła na normalne funkcjonowanie z zachowaniem zadowalającej funkcji nerek. Mamy nadzieję, że zastosowanie drenażu nerki z wykorzystaniem protezy Detour będzie coraz częściej wybieraną metodą leczenia u chorych ze zwężeniem zespolenia moczowodowo-jelitowego po zabiegu cystektomii radyklanej.
dr n med. Andrzej Jerzy Wrona
Szpital Specjalistyczny im. Edmunda Biernackiego w Mielcu
kierownik Oddziału Urologii: dr n. med. Andrzej Jerzy Wrona
lekarz Dominik Chodor
Szpital Specjalistyczny im. Edmunda Biernackiego w Mielcu
kierownik Oddziału Urologii: dr n. med. Andrzej Jerzy Wrona
lekarz Jarosław Zgajewski
Szpital Specjalistyczny im. Edmunda Biernackiego w Mielcu
kierownik Oddziału Urologii: dr n. med. Andrzej Jerzy Wrona
lekarz Michał Piotrowski
Wojewódzki Specjalistyczny Szpital im. M. Pirogowa w Łodzi. Pracownia RTG i TK.
kierownik pracowni: dr n. med. Janusz Ścibór
Piśmiennictwo
- Campbell-Walsh, et al. Urology. 10th ed. International Edition. 2012. Elsevier.
- Weiguo Hu, Boxing Su, Bo Xiao, Xin Zhang, Song Chen, Yuzhe Tang, Yubao Liu, Meng Fu and Jianxing Li, Simultaneous antegrade and retrograde endoscopic treatment of non-malignant ureterointestinal anastomotic strictures following urinary diversion, BMC Urology (2017) 17:61 DOI 10.1186/s12894-017‑0252‑0
- Niall F. Davis, MD; John P. Burke, MD; TED McDermott, MD; Robert Flynn, MD; Rustom P. Manecksha, MD; John A. Thornhill, MD, Bricker versus Wallace anastomosis: A metaanalysis of ureteroenteric stricture rates after ileal conduit urinary diversion Can Urol Assoc J 2015;9(5–6):E284-90. http://dx.doi.org/10.5489/cuaj.2692
- Yam W.L. , Lim S.K.T. , Teo J.K. , Ng K.S. , Ng F.C. , Balloon dilatation of ureteric and ureteroileal strictures, Eur Urol Suppl 2016;15(3);e130
- Sero Andonian, Kevin C. Zorn, Steven Paraskevas and Maurice Anidjar, Artificial Ureters in Renal Transplantation, Urology 66: 1109.e9–1109.e11, 2005
- Xiao-Dong Jin a,b,1, Simone Roethlisberger c,1, Fiona C. Burkhard a, Fre´de´ric Birkhaeuser a, Harriet C. Thoeny d, Urs E. Studer a,Long-term Renal Function After Urinary Diversion by Ileal Conduit or Orthotopic Ileal Bladder Substitution, European Urology 61 (2012) 491–497
- Antonio Rosales, Esteban Emiliani *, Josep T. Salvador, Juan Antonio Pen˜a, Josep M. Gaya,
Joan Palou, Humberto Villavicencio, Laparoscopic Management of Ureteroileal Anastomosis Strictures :
Initial Experience, European Urology 70 (2016) 493–498 - Moschonas D., Soares R., Swinn M., Woodhams S., Mostafid H., Menezes P., Perry M., Patil K., Endoscopic management versus robotic repair of ureteroileal anastomosis strictures after robotic assisted radical cystectomy and ileal conduit formation, Eur Urol Suppl 2016; 15(7):229
- Ballestero Diego R. , Campos F. , Zubillaga Guerrero S. , Velilla Diez G. , Herrero Blanco E. , Calleja Hermosa P., Varea Malo R. ‚Correas Gomez M.A. , Portillo Martin J.A. , Gutierrez Baños J.L. Robot-assisted management for ureteroileal stricture. Description of our technique, Eur Urol Suppl 2017; 16(6);e2457
- Harrech YE, Ghoundale O, Touiti D (2017) Percutaneous Ureteral Dilations for Management of Uretero-Intestinal Anastomosis Stricture following Bricker Urinary Diversion. Urol Nephrol Open Access J 5(3): 00170. DOI: 10.15406/unoaj.2017.05.00170
- Francois Desgrandchamps, Pascal Paulhac, Sophie Forrnairon, Eric De Kerwller, Alain Duboust, Pierre Teillac and Alain Le Duc, Artificial Ureteral Replacement for Ureteral Necrosis after Renal Transplantation: Report of 3 Cases, The Journal of Urology Vol. 159,1830–1832, June 1998
- Haddad N, Andonian S, Anidjar M, Simultaneous bilateral subcutaneous pyelovesical bypass as a salvage procedure in refractory retroperitoneal fibrosis. Can Urol Assoc J 2013;7(5–6):e417-20.http://dx.doi.org/10.5489/cuaj.1395
- Jurczok A, Loertzer H, Wagner S, Fornara P. Subcutaneous nephrovescical and nephrocutaneousbypass: palliative approach to ureteral obstruction caused by pelvic malignancy. Gynecol Obstet Invest 2005;59:144–8. http://dx.doi.org/10.1159/000083088
- Lloyd SN, Tirukonda P, Biyani CS, Wah TM, Irving HC. The detour extra-anatomic stent‑a permanent solution for benign and malignant ureteric obstruction? Eur Urol. 2007 Jul;52(1):193–8. http://dx.doi.org/10.1016/j.eururo.2006.11.008
- Muller CO, Meria P, Desgrandchamps F. Long-term outcome of subcutaneous pyelovesical bypass in extended ureteral stricture after renal transplantation. J Endourol. 2011 Aug;25(8):1389–92. http://dx.doi.org/10.1089/end.2011.0085
- Yazdani M, Gharaati MR, Zargham M. Subcutaneous Nephrovesical Bypass in Kidney Transplanted Patients. Int J Organ Transplant Med. 2010; 1(3): 121–124.
- Azhar RA, Hassanain M, Aljiffry M et al. Successful salvage of kidney allografts threatened by ureteral stricture using pyelovesical bypass. Am J Transplant. 2010 Jun;10(6):1414–9. http://dx.doi.org/10.1111/j.1600–6143.2010.03137.x
- Ahmad I, Pansota MS, Tariq M, et al. Comparison Between Double J (DJ) Ureteral Stenting and Percutaneous Nephrostomy (PCN) in Obstructive Uropathy. Pak J Med Sci 2013;29(3):725–729. http://dx.doi.org/10.12669/pjms.293.3563
- Hsu L, Li H, Pucheril D, Hansen M, Littleton R, Peabody J, Sammon J . Use of percutaneous nephrostomy and ureteral stenting In management of ureteral obstruction. World J Nephrol 2016 March 6; 5(2): 172–181
- Haddad N, Andonian S, Anidjar M, Simultaneous bilateral subcutaneous pyelovesical bypass as a salvage procedure in refractory retroperitoneal fibrosis. Can Urol Assoc J 2013;7(5–6):e417-20. Page 4/6 http://dx.doi.org/10.5489/cuaj.1395
- Andrzej Jerzy Wrona, Jarosław Zgajewski, Norbert Kopeć, Dominik Chodor, Paweł Kopcza, Stefan Klekot, Subcutaneous pyelovesical bypass – Detour bypass – as a solution for ureteric obstruction, Cent European J Urol. 2017; 70(4): 429–433. doi: 10.5173/ceju.2017.1397
Więcej informacji na temat zestawu Detour.
 English
English